Сущность же проявления основных жизненных свойств такой открытой системы, как организм, заключается в том, что под влиянием внешней среды наблюдается постоянный переход одного стационарного состояния в другое, обеспечивающее установление оптимальных для данных условий отношений со средой. Он осуществляется по различным переходным кривым, представленным в упрощенном виде на рис. 13.
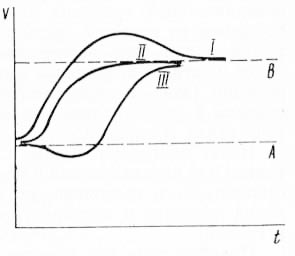 Рис. 13. Основные типы перехода одного стационарного состояния А в другое В: I — переход с избыточным отклонением (типичная кривая при возбуждении); II — переход по типу «экспоненциального приближения» (наиболее экономный переход); III — переход с «ложным стартом».
Рис. 13. Основные типы перехода одного стационарного состояния А в другое В: I — переход с избыточным отклонением (типичная кривая при возбуждении); II — переход по типу «экспоненциального приближения» (наиболее экономный переход); III — переход с «ложным стартом».
Возбуждение, возникновение потенциала действия, сокращение мышцы и другие подобные процессы являются примерами перехода одних стационарных уровней в другие. Способность открытых систем сохранять допустимо возможное стационарное состояние или переходить с одного уровня на другой предполагает одновременно и вещественно-термодинамическую неравновесность открытых систем относительно среды. Однако описанные механизмы поддержания и изменения уровня того или иного стационарного состояния только объясняют само существование стационарного состояния, но не позволяют выявить факторы, его определяющие, т. е. факторы, обусловливающие неравновесность стационарных состояний открытых систем с окружающей средой. Удовлетворительный ответ на этот вопрос дает теория Онзагера (1931; 1945).
Неравновесное состояние, по Онзагеру, определяется наличием сил и вызываемых этими силами потоков. Силы — это все виды существующих в природе градиентов и потенциалов (диффузионные и температурные градиенты, химические и электрические потенциалы и др.). Для биологических систем основной силой является химическая активность, т. е. активность метаболических процессов. Силы вызывают появление потоков. Наиболее важный для биологических систем — диффузионный поток вещества, вызываемый протеканием химических реакций. В результате того или иного химического процесса концентрация веществ в месте произошедшей реакции уменьшается или увеличивается. В обоих случаях возникает диффузионный (концентрационный) градиент, благодаря которому данное вещество поступает из внешней среды в биосистему или наоборот. Примером может быть возникновение и поддержание потенциала покоя, местного потенциала и потенциала действия. Химические реакции (экзо- и эндотермические, экзер- и эндергенические) создают в организме не только диффузионные потоки, но и потоки тепла и энергии.
Итак, благодаря силам и потокам создаются условия не только для возникновения и поддержания того или иного уровня стационарного состояния, но и для неравновесного распределения вещества и температуры между биологической системой и средой.
Подобно тому как понятие «стационарное состояние» предполагало существование неравновесного состояния, так неравновесное состояние предполагает существование у открытых систем свойства сохранять относительно постоянный состав и энергетический потенциал. Специфика этого свойства в свое время была определена принципом Ле Шателье относительно термодинамического равновесия: «Если система находится в состоянии равновесия, то при действии на нее сил, вызывающих нарушение равновесия, система приходит в такое состояние, в котором эффект внешнего воздействия ослабляется». Так, если химическая реакция протекает с уменьшением числа молей (а соответственно и объема), то давление благоприятствует прямой реакции и препятствует обратной (например, N2+3H2↔2NH3, где уменьшение объема обусловлено тем, что вместо 4 молей исходных веществ образуется только 2 моля аммиака).
