Второе ограничение: любая форма энергии может практически полностью перейти в тепловую, но последняя не полностью переходит в иную форму и частично остается в виде теплоты. Это означает, что внутренняя энергия системы неоднородна. Одна часть ее способна к превращениям и к производству полезной работы, другая же при данных условиях этого не может. Первая часть получила название свободной энергии F, вторая — связанной энергии G (по Гельмгольцу). Следовательно, внутренняя энергия системы есть сумма свободной и связанной энергии:
U=F+G
Связанная энергия тем больше, чем меньше разность температур в системе, и в отношении выполнения полезной работы как бы обесценена. Эту непроизводительную энергию называют энтропией S. Для того чтобы в определенных условиях уменьшить энтропию, т. е. поддержать высокий жизненный потенциал, живые организмы должны постоянно заряжаться энергией извне и притом с некоторым запасом, подобно тому как заряжается аккумулятор. Находясь «в долгу» у окружающей природы и тем самым снижая свою энтропию, живые, организмы увеличивают общую энтропию системы организм — среда. Есть все основания полагать, что если бы на Земле не было жизни, ее энтропия была бы значительно меньше. О природе малой энтропии живых существ очень образно сказал Э. Шредингер: «Отрицательная энтропия — вот то, чем организм питается. Или, чтобы выразить это менее парадоксально, существенно в метаболизме то, что организму удается освобождать себя от всей той энтропии, которую он вынужден производить, пока жив».
Временное прекращение поступления энергии извне (прекращение питания) приводит к снижению уровня жизненной активности организма. Эта своеобразная приспособительная реакция преследует основную цель — сократить прирост энтропии при недостаточной компенсации ее свободной энергией извне. Следовательно, живые организмы, безусловно, находятся в сфере действия второго закона термодинамики. Наука располагает возможностью измерить как величину энтропии системы, так и интенсивность антиэнтропийных процессов, необходимых для сохранения данной системы, например живых организмов. Так, связанная энергия и энтропия отражают одно и то же явление.
Всякий раз, когда в системе совершается какой-либо самопроизвольный процесс, осуществляющийся по градиенту, происходит не только перераспределение различных форм энергии, но и увеличение энтропии, которое является своеобразной платой за каждое использование энергии. Следовательно, величина энтропии системы в данный момент ΔS равна разности энтропии системы в начале S1 и в конце S2 процесса:
ΔS=S1-S2
Если процесс обратим, т. е. допускается возвращение системы в первоначальное состояние без каких-либо изменений в окружающей среде, то энтропия этой системы, естественно, равна нулю. При необратимых процессах энтропия системы больше нуля, т. е. она увеличивается. Таким образом, в общем виде величина энтропии может быть выражена формулой
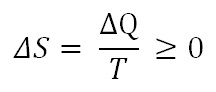 где ΔQ — количество тепла, поглощенного из среды; Т — абсолютная температура.
где ΔQ — количество тепла, поглощенного из среды; Т — абсолютная температура.
Все реальные процессы, осуществляющиеся в окружающем нас мире, необратимы. Это прежде всего касается живой природы. Примером может служить однонаправленность и необратимость возрастных изменений человека в течение жизни (рождение — детство — отрочество — юность — зрелость — старость— смерть). Такое явление объясняется тем, что источником жизнедеятельности живых организмов является химическая энергия, переходящая в работу и тепло, большая часть которого рассеивается в результате теплоотдачи. Кроме того, в соответствии со вторым законом термодинамики полное превращение тепла в работу невозможно.
